医疗器械UDI是何种神器 ——美国FDA医疗器械唯一标识(UDI)系统法规概述
发布时间:2018-11-29医疗器械UDI,这个业内的老话题,终于迎来了新突破。
2018年8月22日,《医疗器械唯一标识系统规则(征求意见稿)》在中国政府法制信息网公示向社会公开征求意见。
UDI系统有何神奇功能?
通过建立UDI系统,有利于运用信息化手段实现对医疗器械在生产、经营和使用各环节的快速、准确识别,有利于实现产品监管数据的共享和整合,有利于创新监管模式,提升监管效能,有利于加强医疗器械全生命周期管理,实现政府监管与社会治理相结合,形成社会共治的局面,进一步提升公众用械安全保障水平。UDI是国际医疗器械监管领域关注的热点,是全球医疗器械监管手段创新和效能提升的发展方向。
2013年,国际医疗器械监管机构论坛(IMDRF)、美国FDA分别发布相关医疗器械唯一标识系统指南及法规,2014年,美国FDA率先对第三类医疗器械实施医疗器械唯一标识。
鉴于美国这个先行者的经验,翻译了2016年1月27日美国FDA器械和放射健康中心(CRDH)监测和生物测定办公室信息副主任LindaSigg女士公开的演讲PPT《医疗器械唯一标识(UDI)系统法规概述》中的重要内容,并在此与大家分享,帮助各位理解UDI。如有表述不准确的地方,欢迎给我们留言纠正。
译文如下:
美国FDA UDI法规发展历程:
基于2012年 FDA 安全与创新法规和2007年FDA修正案(FDAAA),美国FDA于2013年9月24日颁布了医疗器械唯一标识最终法规 (UDI Final Rule)。
推行医疗器械唯一标识的目的
建立一套可在销售和使用过程中全面识别医疗器械的体系
1)便于快速准确地识别医疗器械产品
2)允许访问有关医疗器械产品的重要信息
3)提供标准和清晰的方式来记录电子健康记录,临床信息系统,索赔数据源和注册表中的使用情况
建立一套成功的UDI系统的四个步骤
• 开发标准化系统来创造UDI
• 将UDI标注到标签上和/或医疗器械上(有时)
• 创建和维持全球UDI数据库
• 促进UDI的采用和实施
什么是医疗器械唯一标识UDI?
需要显示在医疗器械标签上、包装上或某些情况下需标注在医疗器械本身,代码须以纯文本以及机器可读模式(AIDC)。
医疗器械唯一标识UDI= 产品标识(DI)+生产标识(PI)
产品标识(DI)
产品标识是UDI强制的固定部分,用来识别医疗器械贴标主体、特定版本或型号的医疗器械,一旦确定,无法改变;且DI可以进入全球UDI数据库(GUDID)。
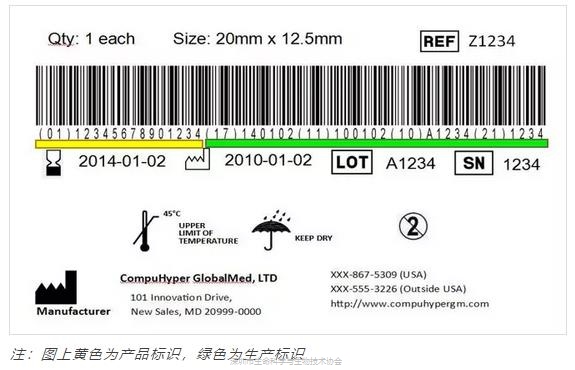
生产标识(PI)
生产标识是UDI的可变部分,可包括批次、序列号、生产日期、失效日期等信息,I类产品不需要。
医疗器械包装
• 医疗器械包装包含固定数量的特定版本或型号的器械
• 每一层级的包装需要不同的UDI
注:货运包装(例如集装箱、托盘)不是医疗器械包装,不需要UDI。
除了标签之外,如果是以下医疗器械,医疗器械本身也必须带有永久标记UDI:
*医疗器械需不止一次使用
*每次使用前都要进行再处理的医疗器械
UDI可通过以下任一或两者提供:
*易于阅读的纯文本
*自动识别和数据捕获(AIDC)技术或任何可根据需要提供UDI的替代技术
永久标示于医疗器械本体的UDI可以是:
*与出现在医疗器械标签上的UDI相同
*不同的UDI用于区分未包装的医疗器械与已包装的医疗器械
什么是贴标主体?
贴标主体对UDI的要求负责。依照21CFR 801.3的定义,任何把标签按下列处理的组织:
• 用于商业目的把标签贴到医疗器械上
• 出于商业目的把标签重置或更改
贴标主体通常为:
• 制造商(通常)
• 合同制造商
• 自有品牌经销商
• 成套器械装配商
UDI发行机构
UDI法规规定:
• UDI必须在由FDA认可的发证机构运营的系统下发行
• 发行机构的系统必须符合UDI规则中的ISO标准
• 认可的初始期限为三年
• 可以延续
• 可能会被FDA撤销
贴标主体需要:
• 与至少一个经认可的发证机构合作
• 使用发行机构的规则来构建其UDI
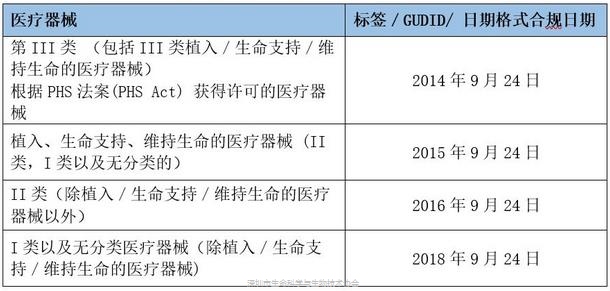
UDI 标识要求的合规日期
不需要UDI的医疗器械
• I类cGMP豁免医疗器械
• 单个销售的一次性医疗器械或储存于单独包装中直至取出使用
• 仅用于非临床用途的IDE或设备
• 仅用于从美国出口的医疗器械
• 成套器械内的部件
• 1976以前上市且FDA没有明确政策的医疗器械
注:查阅21CFR801.30获取完整的UDI豁免医疗器械清单。
UDI豁免与替代方案
• 21 CFR 801.30下的一般豁免情况
• FDA可以授予个体例外或替代方案
• 向UDI帮助平台提交例外和替代方案请求

